某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
请回答:
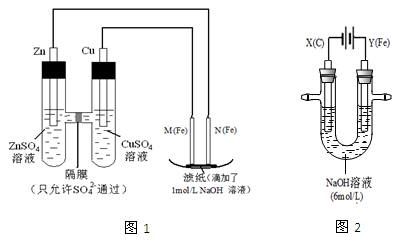
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是(填字母序号)。
(2)N极发生反应的电极反应式为。
(3)实验过程中,SO42-(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH(填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH- ="=" FeO42- + 4H2O 和
。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为: K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2该电池正极发生的反应的电极反应式为。
 的结构简式___________④芳香烃萘
的结构简式___________④芳香烃萘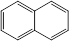 的分子式为
的分子式为  的结构简式___________④芳香烃萘
的结构简式___________④芳香烃萘 的分子式为
的分子式为