β羧乙基锗倍半氧化物(即Ge-132)是与人体健康有关的最重要的有机锗化合物,其片层结构如图1-24所示,其重复结构是由六个锗原子和六个氧原子构成的十二元环。每个锗原子还同时与三个氧原子相连,形成可以任意延伸的片层,每个锗原子连接一个羧乙基(—CH2CH2COOH),各片层间存在相互作用,连接成三维网状结构。
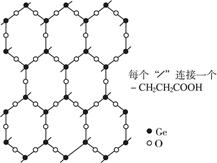
图1-24
(1)每个正六边形拥有 个锗原子, 个氧原子。
(2)试写出Ge132的化学式。
β羧乙基锗倍半氧化物(即Ge-132)是与人体健康有关的最重要的有机锗化合物,其片层结构如图1-24所示,其重复结构是由六个锗原子和六个氧原子构成的十二元环。每个锗原子还同时与三个氧原子相连,形成可以任意延伸的片层,每个锗原子连接一个羧乙基(—CH2CH2COOH),各片层间存在相互作用,连接成三维网状结构。

图1-24
(1)每个正六边形拥有 个锗原子, 个氧原子。
(2)试写出Ge132的化学式。