对十二烷基苯磺酸钠(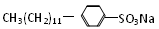 )是常用洗涤剂的主要成分。其结构可用图形“-”“○”来表示,左端为链烃基,右端为极性基。根据这一结构特点,试分析和回答下列问题。
)是常用洗涤剂的主要成分。其结构可用图形“-”“○”来表示,左端为链烃基,右端为极性基。根据这一结构特点,试分析和回答下列问题。
⑴该物质分子在其水溶液表面分布的结构示意图应是图1中的 图(填写序号)。理由是 。
⑵进入介质(水)内部的该物质的分子,可能会以图2所列的结构形式中的 结构形式存在(填写序号)。理由是
对十二烷基苯磺酸钠(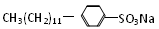 )是常用洗涤剂的主要成分。其结构可用图形“-”“○”来表示,左端为链烃基,右端为极性基。根据这一结构特点,试分析和回答下列问题。
)是常用洗涤剂的主要成分。其结构可用图形“-”“○”来表示,左端为链烃基,右端为极性基。根据这一结构特点,试分析和回答下列问题。
⑴该物质分子在其水溶液表面分布的结构示意图应是图1中的 图(填写序号)。理由是 。
⑵进入介质(水)内部的该物质的分子,可能会以图2所列的结构形式中的 结构形式存在(填写序号)。理由是