利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:2SO2(g)+O2(g) 2SO3(g)△H=-196 kJ·mol-1。
2SO3(g)△H=-196 kJ·mol-1。
(1)该反应的平衡常数表达式为K= ;某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入SO2电极的电极反应式 。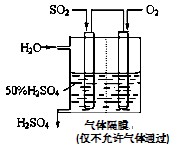
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____ __。
 ”表示硅晶体中的一个原子,请在立方体的顶点用“
”表示硅晶体中的一个原子,请在立方体的顶点用“
 Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。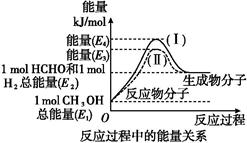
 Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答: 3Cu2++2R+yH2O。
3Cu2++2R+yH2O。 粤公网安备 44130202000953号
粤公网安备 44130202000953号