黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O ="=" SO2- + 2Fe2+ + 4H+
Cr2O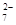 + 6 Fe2+ + 14 H+ ="=" 2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ ="=" 2 Cr3+ + 6 Fe3+ + 7 H2O
⑴.样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵.若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:____________________________________。
⑶.煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
 该盐酸的物质的量浓度为多少?
该盐酸的物质的量浓度为多少? 摩尔HCl被氧化?
摩尔HCl被氧化? 粤公网安备 44130202000953号
粤公网安备 44130202000953号