松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调合香精。
请写出松油醇分别与下列试剂反应所得主要有机产物的结构式(不考虑立体异构体):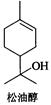
I、Br2/CC14; II、KMnO4(稀、冷溶液);
III、KMnO4/ H3O+; IV、PBr3;
V、(a) Na,(b) CH3I; VI、CH3COC1/碱。
松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调合香精。
请写出松油醇分别与下列试剂反应所得主要有机产物的结构式(不考虑立体异构体):
I、Br2/CC14; II、KMnO4(稀、冷溶液);
III、KMnO4/ H3O+; IV、PBr3;
V、(a) Na,(b) CH3I; VI、CH3COC1/碱。