现有NH4Cl和氨水组成的混合溶液。请回答下列问题(填“>”、“<”或“=”):
(1)若溶液的pH=7,则该溶液中c(NH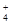 )_________c(Cl—)。
)_________c(Cl—)。
(2)若溶液的pH>7,则该溶液中c(NH+)_________c(Cl—)。
(3)若c(NH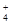 )<c (Cl—),则溶液的pH__________7。
)<c (Cl—),则溶液的pH__________7。
现有NH4Cl和氨水组成的混合溶液。请回答下列问题(填“>”、“<”或“=”):
(1)若溶液的pH=7,则该溶液中c(NH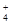 )_________c(Cl—)。
)_________c(Cl—)。
(2)若溶液的pH>7,则该溶液中c(NH+)_________c(Cl—)。
(3)若c(NH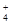 )<c (Cl—),则溶液的pH__________7。
)<c (Cl—),则溶液的pH__________7。