实验室开放日,某化学兴趣小组的同学在老师的指导下,进行了“自选仪器设计实验”的活动.实验室准备的仪器如下图所示: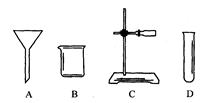
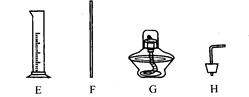
(1) 小凡同学一眼就认出仪器E是_________,G是___________。
(2) 小明同学利用上述仪器进行粗盐水的过滤,他选择了漏斗和铁架台,你认为他还需选择的仪器是____________、_______________(填名称)。
(3) 小强同学准备配制100g15.8%的食盐溶液,你认为还缺少的一种主要仪器是__。
实验室开放日,某化学兴趣小组的同学在老师的指导下,进行了“自选仪器设计实验”的活动.实验室准备的仪器如下图所示:

(1) 小凡同学一眼就认出仪器E是_________,G是___________。
(2) 小明同学利用上述仪器进行粗盐水的过滤,他选择了漏斗和铁架台,你认为他还需选择的仪器是____________、_______________(填名称)。
(3) 小强同学准备配制100g15.8%的食盐溶液,你认为还缺少的一种主要仪器是__。