碳及其化合物有广泛的用途。
(1)在电化学中,常用碳作电极:
①在酸性锌锰干电池中,碳棒作极。
②若用碳棒和铁棒做电极电解饱和食盐水生产烧碱时,碳棒作极,反应的离子方程式。
(2)将水蒸气通过红热的碳可产生水煤气:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是。
CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是。
| A.升高温度 |
B.增加碳的用量 |
| C.加入催化剂 |
D.用CO吸收剂除去CO |
(3)将一定量的CO(g)和H2O(g)通过某恒容的密闭容器中,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g)得到如下数据:
CO2(g)+H2(g)得到如下数据:
温度/℃
|
起始浓度mol/L
|
平衡浓度mol/L
|
CO(g)
|
H2O(g)
|
H2(g)
|
900
|
2.0
|
0.8
|
0.4
|
通过计算,该反应的平衡常数为:。
(4)工业上把水煤气中的混合气体处理后,获得较纯的H2用于合成氨:
N2(g)+3H2(g)一定条件下2NH3(g)△H= —92.4kJ/mol某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图:
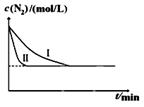
①与实验I比较,实验II改变的条件为:。
②实验III比实验I的温度要高,其它条件相同,请在下图画出实验I和实验III中NH3浓度随时间变化的示意图。