在一烧杯中盛有Na2CO3和NaOH的混合物10g,向其中加入100g水,固体全部溶解。向所得溶液中滴加澄清石灰水,产生沉淀的质量与滴入石灰水的质量关系曲线如图所示。请根据题意回答下列问题: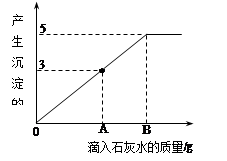
(1)在滴入石灰水时,产生沉淀的颜色是______。
(2)当滴入石灰水至图中A点时,烧杯中溶液里含有的溶质是(写化学式) 。
(3)计算当滴入石灰水至图中B点时,溶液中溶质的质量为多少?(计算结果精确至0.1g)
在一烧杯中盛有Na2CO3和NaOH的混合物10g,向其中加入100g水,固体全部溶解。向所得溶液中滴加澄清石灰水,产生沉淀的质量与滴入石灰水的质量关系曲线如图所示。请根据题意回答下列问题: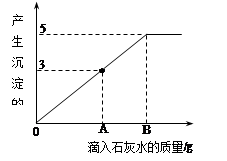
(1)在滴入石灰水时,产生沉淀的颜色是______。
(2)当滴入石灰水至图中A点时,烧杯中溶液里含有的溶质是(写化学式) 。
(3)计算当滴入石灰水至图中B点时,溶液中溶质的质量为多少?(计算结果精确至0.1g)