聚甲基丙烯酸酯纤维具有质轻、频率宽等特性,广泛应用于制作光导纤维。已知A为某种聚甲基丙烯酸酯纤维的单体,其转化关系如下:
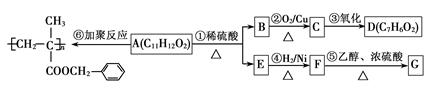
(1)D含有的含氧官能团的名称是______________。
(2)⑤的反应类型是____________。
(3)根据系统命名法,F的名称是______ _______。
_______。
(4)E不能发生的反应是(填写字母标号)
| A.能使酸性高锰酸钾溶液褪色 |
B.能使溴的CCl4溶液褪色 |
| C.一定条件下,能够发生消去反应 |
D.一定条件下,能够发生取代反应 |
(5)F的同分异构体中,属于酯类的有____________种。
(6)G的结构简式为。
(7)一定条件下,E可以发生加聚反应,化学方程式为。