某化学小组设计实验验证温度对化学反应速率的影响。
【实验用品】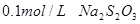 溶液、
溶液、 、烧杯、冷水、热水、秒表等
、烧杯、冷水、热水、秒表等
【实验步骤】
I.取两支试管各加入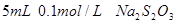 。
。
II. 另取两支试管各加入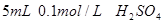 。
。
III. ……
IV. 一段时间后,分别混合并搅拌。
V. 记录实验现象及数据。
(1)步骤III的操作为 。
(2)该实验需要记录的实验数据是 。
(3)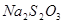 和
和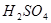 反应的化学方程式为 。
反应的化学方程式为 。
(4)能说明温度升高反应速率增大的现象是 。
某化学小组设计实验验证温度对化学反应速率的影响。
【实验用品】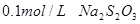 溶液、
溶液、 、烧杯、冷水、热水、秒表等
、烧杯、冷水、热水、秒表等
【实验步骤】
I.取两支试管各加入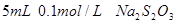 。
。
II. 另取两支试管各加入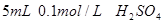 。
。
III. ……
IV. 一段时间后,分别混合并搅拌。
V. 记录实验现象及数据。
(1)步骤III的操作为 。
(2)该实验需要记录的实验数据是 。
(3)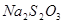 和
和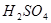 反应的化学方程式为 。
反应的化学方程式为 。
(4)能说明温度升高反应速率增大的现象是 。