某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。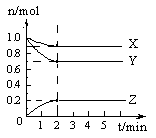
(1)反应开始至2 min,Y的平均反应速率为 ;
(2)分析有关数据,写出X、Y、Z的反应方程式:
;
(3)反应达到最大限度时,Y的转化率为 。
某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
(1)反应开始至2 min,Y的平均反应速率为 ;
(2)分析有关数据,写出X、Y、Z的反应方程式:
;
(3)反应达到最大限度时,Y的转化率为 。