(1)多羟基连在同一个碳原子上易自动失水生成醛或酮。请写出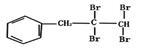 NaOH的水溶液共热的化学方程式为____________。
NaOH的水溶液共热的化学方程式为____________。
(2)苯腙是有机染料的主要原料,由醛(或酮)与苯肼生成苯腙的反应为:
反应①的原子利用率为100%,则中间产物A的结构简式为____________;
反应②的反应类型属于____________。
(3)由对苯二甲醛( )的氧化产物“对苯二甲酸”与“乙二醇”发生缩聚,生成的聚酯纤维(涤纶)的结构简式为____________。
)的氧化产物“对苯二甲酸”与“乙二醇”发生缩聚,生成的聚酯纤维(涤纶)的结构简式为____________。
(1)多羟基连在同一个碳原子上易自动失水生成醛或酮。请写出 NaOH的水溶液共热的化学方程式为____________。
NaOH的水溶液共热的化学方程式为____________。
(2)苯腙是有机染料的主要原料,由醛(或酮)与苯肼生成苯腙的反应为:
反应①的原子利用率为100%,则中间产物A的结构简式为____________;
反应②的反应类型属于____________。
(3)由对苯二甲醛( )的氧化产物“对苯二甲酸”与“乙二醇”发生缩聚,生成的聚酯纤维(涤纶)的结构简式为____________。
)的氧化产物“对苯二甲酸”与“乙二醇”发生缩聚,生成的聚酯纤维(涤纶)的结构简式为____________。