木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下:
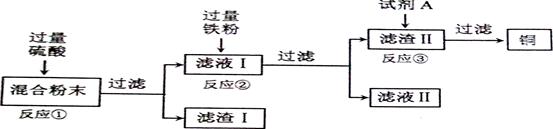
(1)写出下列反应的化学方程式:
反应①:
反应②:
(2)反应①所用的硫酸的质量分数为24.5%。现要配制40g 24.5%的硫酸,需

(3)在进行"反应①"、"反应②"、"反应③"的操作时,可将反应物加入
(4)试剂A可选用
(5)为了从混合粉末中回收更多的铜,可对实验方案进行修改和完善,你的建议是(提出一条即可)
木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下:

(1)写出下列反应的化学方程式:
反应①:
反应②:
(2)反应①所用的硫酸的质量分数为24.5%。现要配制40g 24.5%的硫酸,需

(3)在进行"反应①"、"反应②"、"反应③"的操作时,可将反应物加入
(4)试剂A可选用
(5)为了从混合粉末中回收更多的铜,可对实验方案进行修改和完善,你的建议是(提出一条即可)