短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):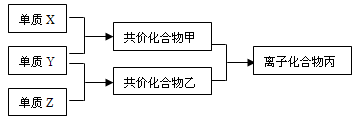
已知:a、常见双原子单质分子中,X分
子含共用电子对数目最多。b、甲分子含
10个电子,且能使湿润的红色石蕊试纸
变蓝,乙分子含18个电子。
(1)X的结构式: ;丙的电子式:
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。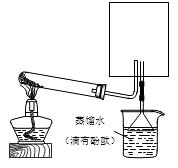
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中发生反应的化学方程式是:
③烧杯中溶液由无色变为红色,其原因是:(用电离方程式表示)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号