我省的海水资源丰富,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我省可持续发展的重要保证。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出由无水氯化镁制取金属镁的化学反应方程式。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入(选填“Na2S”或“NaOH”)效果更好。
难溶电解质
|
Cu(OH)2
|
CuS
|
Pb(OH)2
|
PbS
|
Ksp
|
4.8×10-20
|
6.3×10-36
|
1.2×10-15
|
1.0×10-28
|
(3)火力发电在江苏的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
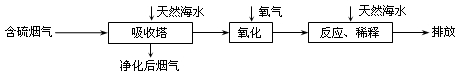
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因(任写一个)。
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示。
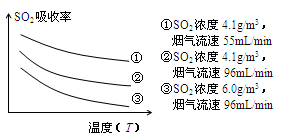
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,氧气氧化的化学原理是(任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是。