(共6分)如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题: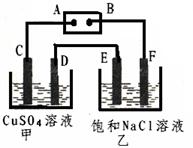
(1)电极A的名称是
(2)甲装置中电解反应的总化学方程式
是
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH =__________。
(共6分)如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:
(1)电极A的名称是
(2)甲装置中电解反应的总化学方程式
是
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH =__________。