为了达到下表中的实验目标,请从“供选择的化学试剂及方法”栏中,选择正确的选项的字母代号填入对应的空格中。
| 序号 |
实验目标 |
答案 |
供选择的化学试剂及方法 |
| (1) |
识别棉织品和毛织品 |
|
A让一束光透过 B通过盛溴水的洗气瓶 C抽少许纱,灼烧 D新制的 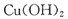 ,加热 ,加热 |
| (2) |
鉴别溶液和胶体 |
|
|
| (3) |
化验糖尿病 |
|
|
| (4) |
除去甲烷中少量乙烯 |
|
为了达到下表中的实验目标,请从“供选择的化学试剂及方法”栏中,选择正确的选项的字母代号填入对应的空格中。
| 序号 |
实验目标 |
答案 |
供选择的化学试剂及方法 |
| (1) |
识别棉织品和毛织品 |
|
A让一束光透过 B通过盛溴水的洗气瓶 C抽少许纱,灼烧 D新制的 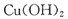 ,加热 ,加热 |
| (2) |
鉴别溶液和胶体 |
|
|
| (3) |
化验糖尿病 |
|
|
| (4) |
除去甲烷中少量乙烯 |
|