某学生用0.2000 mol/L KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.将已用蒸馏水洗净的碱式滴定管,再用标准溶液润洗碱式滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至刻度0以上2~3厘米 |
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
G.检查酸式滴定管和碱式滴定管是否漏水
H.再重复做滴定实验2~3次,记录并处理数据。
就此实验完成以下填空:
(1)正确操作步骤的顺序是(用字母填写短缺的序号)
→ B → → C → → A→ → H
(2)判断到达滴定终点的实验现象是_ 。
(3)如果不进行B步骤的操作的则对滴定结果的影响是____ ______。(填“偏高”、“偏低”、“不影响”,下同)
(4)上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(5)若用酸式滴定管取20.00 mL待测盐酸溶液时,取前有气泡,取后无气泡,其结果会导致测得待测盐酸溶液物质的量浓度 。
(6)若称量一定质量的KOH固体(含少量K2CO3)配制标准溶液并用来滴定上述盐酸,则对滴定结果的影响是
 。根据这两种溶液的配制情况回答下列问题:
。根据这两种溶液的配制情况回答下列问题: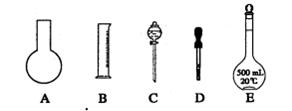
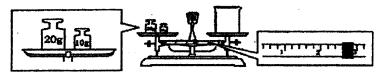
 溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C。
溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C。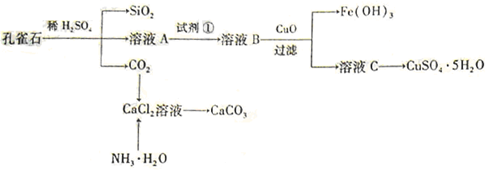
 ),检验溶液A中Fe3+的最佳试剂为 (填代号)。
),检验溶液A中Fe3+的最佳试剂为 (填代号)。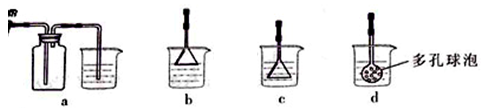
 )欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时俯视容量瓶的刻度线,会使配制的浓度。(填“偏高”、“偏低”、“无影响”。)
)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时俯视容量瓶的刻度线,会使配制的浓度。(填“偏高”、“偏低”、“无影响”。) 粤公网安备 44130202000953号
粤公网安备 44130202000953号