(10株洲30).(7分)化学老师谢××交给某研究性学习小组一个任务:测定实验室里一瓶久置的NaOH固体是否变质。该小组的同学进行了如下实验探究:
【提出问题】 猜想I:没变质,全部是NaOH;猜想II:部分变质,既含有NaOH{又
含有Na2CO3:猜想Ⅲ:完全变质,全部是Na2CO3。
【查阅资料】①已知反应:BaCl2+Na2CO3=2NaCl+BaCO3↓
②部分盐溶液在常温下的pH如下:
| 盐溶液 |
NaCI |
Na2CO3 |
BaCl2 |
| pH |
等于7 |
大于7 |
等于7 |
【设计方案并进行实验】请你与他们一起共同完成,并回答所给问题。
| 实验步骤 |
实验现象 |
实验结论 |
| ①称取上述氢氧化钠固体样品8.0g溶于50ml,水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应后,静置。 |
产生白色沉淀 |
说明久置固体中,一定含有 (1 ) (填化学式)。 |
| ②用玻璃棒蘸取少量①中充分反应后的上层清液滴在一小块pH试纸上,与标准比色卡对比,测出pH |
pH=11 |
说明久置固体中,还一定含有 (2) (填化学式)。 |
上述步骤①中,所用称量仪器的名称是 (3) ,滴加过量BaCl2溶液的目的是 (4)
【实验结论】通过实验,说明上述猜想中 (5) 是正确的。
【拓展】该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、
干燥,称得其质量为2.0g,则原试剂中NaOH的质量分数为 (6) (假定试剂中无其它杂质)。
【反思】久置的氢氧化钠变质的原因是 (7) (用化学方程式表示)。
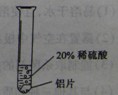
 (3)两种方案,你认为不能达到目的的是________(填“A”或“B”),理由是________。
(3)两种方案,你认为不能达到目的的是________(填“A”或“B”),理由是________。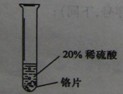

 粤公网安备 44130202000953号
粤公网安备 44130202000953号