根据条件推测下列有机物名称,其中A、B为不饱和烃,C为高分子化合物。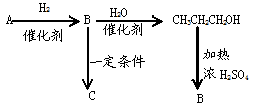
(1)写出各物质结构简式A B
(2)写出下列转化反应方程式及反应类型
B→C ,
CH3CH2 CH2OH→B的方程式 ,
A和溴水(足量)的化学方程式 ,
根据条件推测下列有机物名称,其中A、B为不饱和烃,C为高分子化合物。
(1)写出各物质结构简式A B
(2)写出下列转化反应方程式及反应类型
B→C ,
CH3CH2 CH2OH→B的方程式 ,
A和溴水(足量)的化学方程式 ,