能源是影响全球经济和生活的重要因素。目前人类已开发和利用的能源中,氢所是最理想的清洁能源之一。已知反应:2H2+O2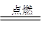 2H2O,试回答下列问题。
2H2O,试回答下列问题。
(1)该反应为 反应(填“吸热”或“放热”);
(2)当生成18gH2O时,H2O的物质的量是 (填字母代号)。
A.1mol B.1mol/L C.1g/mol
能源是影响全球经济和生活的重要因素。目前人类已开发和利用的能源中,氢所是最理想的清洁能源之一。已知反应:2H2+O2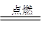 2H2O,试回答下列问题。
2H2O,试回答下列问题。
(1)该反应为 反应(填“吸热”或“放热”);
(2)当生成18gH2O时,H2O的物质的量是 (填字母代号)。
A.1mol B.1mol/L C.1g/mol