铁、铝的混合物进行如下实验: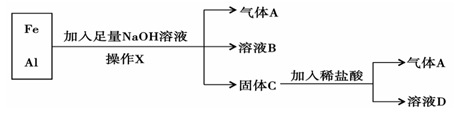
(1)操作X的名称是 。(2)气体A是 (填化学式)。
(3)A与Cl2混合光照可能发生爆炸,生成 (填化学式),A在该反应中作为
(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有 (填化学式),溶液D中存在的金属离子为 (填化学式)。
铁、铝的混合物进行如下实验:
(1)操作X的名称是 。(2)气体A是 (填化学式)。
(3)A与Cl2混合光照可能发生爆炸,生成 (填化学式),A在该反应中作为
(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有 (填化学式),溶液D中存在的金属离子为 (填化学式)。