某课外学习小组为探究硫酸亚铁晶体(FeSO4·7H2O)制备及影响因素,进行如下实验。
Ⅰ.制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25 mL 3 mol·L-1硫酸,用酒精灯加热。
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体。产生该现象的原因是 (用化学方程式表示)。
(2)制备过程中,铁需过量的原因是 。
Ⅱ.实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下
改进:①反应前通入氮气;
②水浴加热,控制温度50~60℃;
③实验中适当补充硫酸调节pH=2;
④增加尾气吸收装置。
改进装置如图(夹持和加热装置略去)。
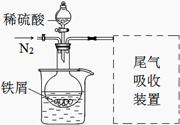
(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是 。
(4)调节pH=2目的是 。
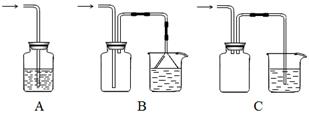
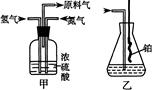
(5)下列装置适合尾气吸收的是 (填序号)。
Ⅲ.晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体。准确称取晶体 0.5000g置于锥形瓶中,加入10mL3molL-1硫酸溶液和15mL新煮沸过的蒸馏水进行溶解,立即用0.02000mol·L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90 mL。(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在 滴定管(填“酸式”或“碱式”)。
②获得硫酸亚铁晶体的纯度为 。
 MnCl2+Cl2 +2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
MnCl2+Cl2 +2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:


 粤公网安备 44130202000953号
粤公网安备 44130202000953号