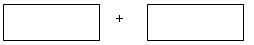某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中,H2O2只发生如下过程:H2O2→O2。
(1)该物质H2O2在反应中表现出 (填写编号)。
a、氧化性 b、还原性 c、氧化性和还原性 d、均不正确
(2)若反应转移了5.418×1023个电子,则产生的气体在标准状况下的体积是________L。
(3)将 氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并求出电子转移的数目:
氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并求出电子转移的数目: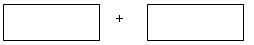
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中,H2O2只发生如下过程:H2O2→O2。
(1)该物质H2O2在反应中表现出 (填写编号)。
a、氧化性 b、还原性 c、氧化性和还原性 d、均不正确
(2)若反应转移了5.418×1023个电子,则产生的气体在标准状况下的体积是________L。
(3)将 氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并求出电子转移的数目:
氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并求出电子转移的数目: