某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-离子,当向该溶液加入某浓度的NaOH溶液时,发现生成沉淀的物质的量 随NaOH溶液的体积变化如图所示,
随NaOH溶液的体积变化如图所示,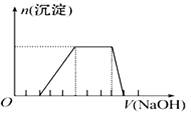
由此可知,该溶液中肯定含有的阳离子是_______________________,且各离子的物质的量之比为_____ ;肯定不含的阳离子是_____________ 。
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-离子,当向该溶液加入某浓度的NaOH溶液时,发现生成沉淀的物质的量 随NaOH溶液的体积变化如图所示,
随NaOH溶液的体积变化如图所示,
由此可知,该溶液中肯定含有的阳离子是_______________________,且各离子的物质的量之比为_____ ;肯定不含的阳离子是_____________ 。