已知A、B是常见的气体单质且B呈黄绿色,F遇KSCN溶液变血红色,各物质之间的转化关系如右图所示。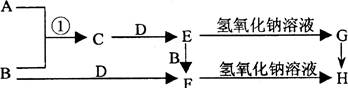
(1)写出下列各物质的化学式:D 、E 、G 。
(2)写出反应①的化学方程式: 。
写出F→H的离子方程式 。
(3)描述G→H反应的现象 。
已知A、B是常见的气体单质且B呈黄绿色,F遇KSCN溶液变血红色,各物质之间的转化关系如右图所示。
(1)写出下列各物质的化学式:D 、E 、G 。
(2)写出反应①的化学方程式: 。
写出F→H的离子方程式 。
(3)描述G→H反应的现象 。