已知:2NO2(g) N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答:
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答: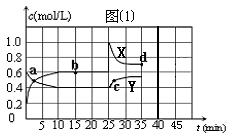
(1)a点时,v(正) v(逆)(填“<”、“>”或“=”),X线、Y线中代表N2O4的是 ;
(2)反应在第10 min达到平衡,则前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。该温度下,反应的平衡常数K= (可用分数表示);
(3)在第25分钟,进行的操作是 ;
(4)a、b、c、d四点对应的时刻,NO2物质的量浓度由小到大的顺序是 ,再次平衡时的d点NO2的体积分数比b点时 (填“大”、“小”或“相等”);
(5)假如在第35分钟从容器中移去0.4mol N2O4,并加入适当催化剂使反应在第40分钟达到平衡,请在图⑴中画出从第35分钟以后两种物质的物质的量浓度c随时间t的变化关系,并标注所画线条对应的物质。
相关知识点
 2NH3(g)
2NH3(g) H=-92.2kJ·mol-1。在一定条件下反应时,当电子转移3mol时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当电子转移3mol时,放出的热量为 。

 乙+丙
乙+丙 氧化物+H2O
氧化物+H2O 丙。则:
丙。则:


 粤公网安备 44130202000953号
粤公网安备 44130202000953号