(8分)有一包白色粉末,其中可能含有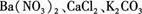 ,现做以下实验。
,现做以下实验。
(1)将部分粉末加入水中,振荡,有白色沉淀生成;
(2)向(1)的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;
(3)取少量(2)的溶液滴入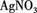 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
根据上述实验 现象,判断白色粉末中一定含有 (填化学式),可能含自 (填化学式)。写出(3)中有关反应的离子方程式 。
现象,判断白色粉末中一定含有 (填化学式),可能含自 (填化学式)。写出(3)中有关反应的离子方程式 。
(8分)有一包白色粉末,其中可能含有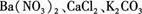 ,现做以下实验。
,现做以下实验。
(1)将部分粉末加入水中,振荡,有白色沉淀生成;
(2)向(1)的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;
(3)取少量(2)的溶液滴入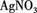 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
根据上述实验 现象,判断白色粉末中一定含有 (填化学式),可能含自 (填化学式)。写出(3)中有关反应的离子方程式 。
现象,判断白色粉末中一定含有 (填化学式),可能含自 (填化学式)。写出(3)中有关反应的离子方程式 。