(9分)某烃类化合物A的质谱图表明其 相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为 ▲ ;
(2)A中的碳原子是否都处于同一平面? ▲ (填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。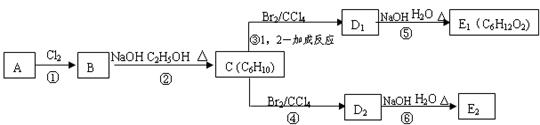

反应②的化学方程式为 ▲ ;C的化学名称为 ▲ ;
E2的结构简式是 ▲ ;④、⑥的反应类型依次是 ▲
 。
。
(9分)某烃类化合物A的质谱图表明其 相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为 ▲ ;
(2)A中的碳原子是否都处于同一平面? ▲ (填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。

反应②的化学方程式为 ▲ ;C的化学名称为 ▲ ;
E2的结构简式是 ▲ ;④、⑥的反应类型依次是 ▲
 。
。