为探索工业含铝、铁、铜合金废料的再利用,某同学设计的实验方案如下: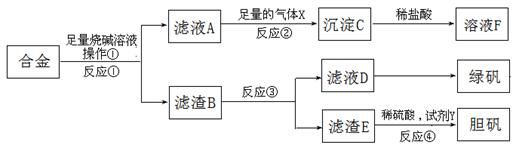
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式 ,
反应②的离子反应方程式 。
(3)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
为探索工业含铝、铁、铜合金废料的再利用,某同学设计的实验方案如下:
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式 ,
反应②的离子反应方程式 。
(3)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。