铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(一)用铁屑与硫酸反应制备FeSO4
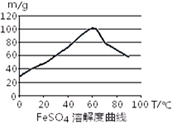
已知4Fe2++O2+4H+= 4Fe3++2H2O。FeSO4在水中的溶解度见图。
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液。此处:硫酸浓度应选择
| A.浓硫酸 |
B.10moL/L硫酸 |
C.3moL/L硫酸 |
D.任意浓度硫酸; |
温度宜控制在______;加热的同时需适当补充水,原因是。反应中应保持n(Fe)/n(H2SO4)1(填“<”、“>”或“=”)。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得。过程中稀硫酸的作用是 。
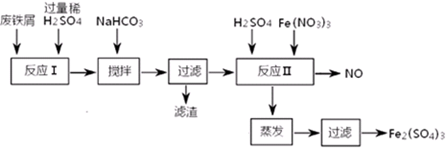
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:
沉淀物
|
Fe(OH)3
|
Fe(OH)2
|
Al(OH)3
|
开始沉淀
|
2.3
|
7.5
|
3.4
|
完全沉淀
|
3.2
|
9.7
|
4.4
|
(4)加NaHCO3时,混合液pH值应控制在_______________________。
(5)反应Ⅱ中反应的离子方程式是:___________________。
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是________,气体X与NO配比的比例是_____________。