尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
第1步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1=" —330.0" kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l) △H1=" —330.0" kJ·mol-1
第2步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2="+226.3" kJ·mol-1
H2O(l)+H2NCONH2(l) △H2="+226.3" kJ·mol-1
(1)写出工业合成尿素的热化学方程式:
(2)下列措施中有利于提高尿素的产率的是___________。
| A.采用高温 | B.采用高压 | C.添加高效催化剂 | D.定时分离尿素 |
(3)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图所示: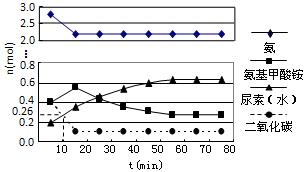
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= 。
(4)工业上合成氨常与尿素生产联合进行以提高经济效益,合成氨的热化学方程式如下:
N2(g) + 3H2(g)  2NH3(g) △H = —92.4 kJ/mol
2NH3(g) △H = —92.4 kJ/mol
请在答题卡的坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)。
(5)有一工业投产前小实验:在一定温度和压强下,将6 molH2和2 molN2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数约为11.1%(即1/9),此时H2的转化率是多少?(写出计算过程,计算结果保留3位有效数字。)

 NCl3+3H2↑;假设NCl3中氮元素为+3价。
NCl3+3H2↑;假设NCl3中氮元素为+3价。 2SO3(g)△H=-198kJ·mol-1
2SO3(g)△H=-198kJ·mol-1





 粤公网安备 44130202000953号
粤公网安备 44130202000953号