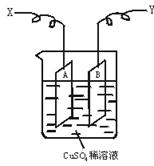
(1)当以I="0.21" A的电流电解60 min后,测得铜片A的质量增加了0.25 g,则图装置中的X端应与直流电的__________极相连,它是电解池的__________极。
(2)电解后铜片B的质量__________。(答“增加”“减少”或“不变”)
(3)列式计算实验测得的阿伏加德罗常数NA。(已知电子电量e=1.60×10-19C)

(1)当以I="0.21" A的电流电解60 min后,测得铜片A的质量增加了0.25 g,则图装置中的X端应与直流电的__________极相连,它是电解池的__________极。
(2)电解后铜片B的质量__________。(答“增加”“减少”或“不变”)
(3)列式计算实验测得的阿伏加德罗常数NA。(已知电子电量e=1.60×10-19C)