某有机物A的结构简式如图。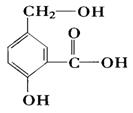
(1)1mol A与NaOH溶液充分反应,消耗NaOH的物质的量是 。
(2)1mol A与金属钠在一定条件下充分反应可生成标准状况下气体的体积为 。
(3)A与NaHCO3溶液反应的化学方程式是: 。
某有机物A的结构简式如图。
(1)1mol A与NaOH溶液充分反应,消耗NaOH的物质的量是 。
(2)1mol A与金属钠在一定条件下充分反应可生成标准状况下气体的体积为 。
(3)A与NaHCO3溶液反应的化学方程式是: 。