(1)硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水,其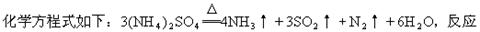
成的氧化产物与还原产物分子个数之比为_______________。
(2)某钠盐A的溶液,实验时有以下一现象:(1)加入Ba(NO3)2溶液时出现白色沉淀,(2)加入Na2CO3,有气泡产生,由此可判断出该钠盐A为___________(化学式),写出有关离子方程式_____________________________,____________________________________。
(1)硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水,其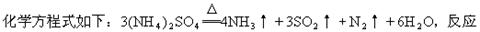
成的氧化产物与还原产物分子个数之比为_______________。
(2)某钠盐A的溶液,实验时有以下一现象:(1)加入Ba(NO3)2溶液时出现白色沉淀,(2)加入Na2CO3,有气泡产生,由此可判断出该钠盐A为___________(化学式),写出有关离子方程式_____________________________,____________________________________。