如图:在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下:A、B和C均为4.0 mol,D为6.5 mol,F为2.0 mol,设E为x mol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于正中位置。请填写以下空白:
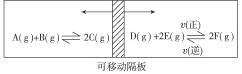
若x=4.5,则右侧反应在起始时向____________(填“正反应”或“逆反应”)方向进行。欲使起始反应维持向该方向进行,则x的最大取值应小于______________。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量_________(填“相等”“不相等”或“不能确定”)。其理由是_______________。