下图所示是可逆反应A+2B 2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况:
2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况: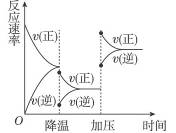
由图可判断:
(1)正反应是_____________(吸热、放热)反应。
(2)若A、B是气体,则C的状态是__________,D的状态是______________。
下图所示是可逆反应A+2B 2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况:
2C+3D的化学反应速率和化学平衡随外界条件改变而变化的情况:
由图可判断:
(1)正反应是_____________(吸热、放热)反应。
(2)若A、B是气体,则C的状态是__________,D的状态是______________。