我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
测试时间/h
|
0
|
1
|
2
|
3
|
4
|
雨水的pH
|
4.73
|
4.62
|
4.56
|
4.55
|
4.55
|
分析数据,回答下列问题:(已知Cl2+SO2+2H2O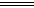 H2SO4+2HCl)
H2SO4+2HCl)
①雨水样品的pH变化的原因是(用化学反应方程式表示)____________________。
②如果将刚取样的上述雨水和自来水相混合,pH将变________(填“大”或“小”)。
(2)你认为减少酸雨产生的途径可采用的措施是________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
| A.①②③ |
B.②③④⑤ |
C.①③⑤ |
D.①③④⑤ |