某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_________________________________________;
__________________________________________。
(2)加入硫酸铜溶液后可以加快氢气生成速率的原因是_____________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中氢气生成速率,还可采取的措施有___________________________
____________________________________________________________ (答两种即可)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验:
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol/L H2SO4(mL) |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液(mL) |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O(mL) |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_____________________________________________________________________________________________________________________________。

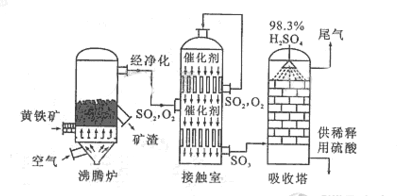

 的转化率
的转化率 气体与
气体与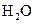 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。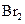 。
。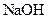 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
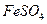 溶液与稍过量的
溶液与稍过量的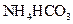 溶液混合,得到含
溶液混合,得到含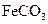 的浊液
的浊液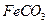 固体
固体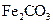 固体
固体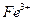 ,该反应的离子方程式是
,该反应的离子方程式是 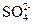 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验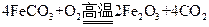 ,现煅烧464.0kg的
,现煅烧464.0kg的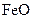 ,则该产品中
,则该产品中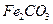 的质量是 kg(摩尔质量/g·
的质量是 kg(摩尔质量/g·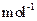 ;
;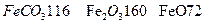 )
)

 粤公网安备 44130202000953号
粤公网安备 44130202000953号