下列共有十四种化学符号: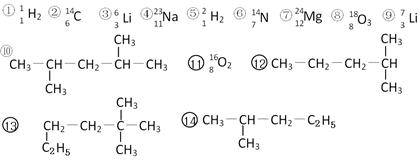
其中:
(1)表示核素的符号共有 种;
(2)互为同位素的是 (填序号,以下相同);
(3)中子数相等,但质子数不相等的是 ;
(4)有机物中是同一种物质的是 ;
(5)⑩的一氯代物的同分异构体数目: ;⒀的一氯代物的同分异构体数目: 。
下列共有十四种化学符号:
其中:
(1)表示核素的符号共有 种;
(2)互为同位素的是 (填序号,以下相同);
(3)中子数相等,但质子数不相等的是 ;
(4)有机物中是同一种物质的是 ;
(5)⑩的一氯代物的同分异构体数目: ;⒀的一氯代物的同分异构体数目: 。