(1)氨在国民经济中占有重要地位。
工业合成氨的反应原理为:N2(g)+ 3H2(g) 2NH3(g) △H="―92.4" kJ·mol-1。
2NH3(g) △H="―92.4" kJ·mol-1。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q 184.8 kJ(填“>”、“<”或“=”)。
②已知:
1mol N—H键断裂吸收的能量为 kJ。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(H2)= mol·L-1·min-1,该温度下反应的平衡常数K = 。欲增大氮气的平衡转化率,可采取的措施有 (写一种措施即可)。
(2)某课外小组用下图所示装置对电解原理进行实验探究。用下图所示装置进行实验。实验过程中,两极均有气体产生,Y极区产生氧气,同时Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。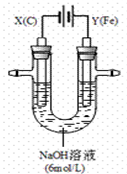
① 电解过程中,X极区溶液的pH (填“增大”、“减小”或“不变”)。
② 电解过程中,Y极发生的两个电极反应为Fe-6e-+8OH-="=" FeO42-+4H2O和 。
③ 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
④在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2,该电池正极发生的反应的电极反应式为 。
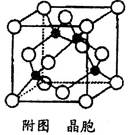
 等离子。
等离子。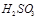 、
、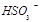 、
、 等氧化,试写出其中一个反应的方程式:。
等氧化,试写出其中一个反应的方程式:。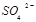 浓度与进入吸收塔的天然海水相比,
浓度与进入吸收塔的天然海水相比,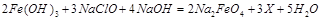 ,则X的化学式为。
,则X的化学式为。

 。由此看来,高铁酸钠能够杀菌消毒是因为它具有性,而能够除去水中悬浮物是因为。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有性,而能够除去水中悬浮物是因为。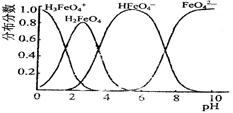
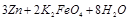

 则电池正极材料是,充电时电池正极(填“得”“失”)电子,放电时电池的负极反应式为。
则电池正极材料是,充电时电池正极(填“得”“失”)电子,放电时电池的负极反应式为。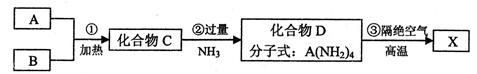
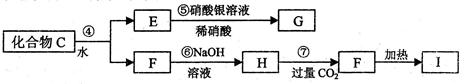
 。
。
 2NH3(g))在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料。按要求回答下列问题:
2NH3(g))在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料。按要求回答下列问题: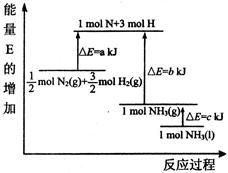
 粤公网安备 44130202000953号
粤公网安备 44130202000953号