(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。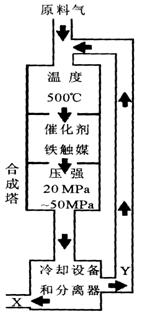
①X的化学式为 ;
②上图中条件选定的主要 原因是(选填字母序号) ;
原因是(选填字母序号) ;
A.温度、压强对化学平衡影响 B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母代号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应
,
②氨水中水电离出的c(OH-) 10-7mol/L(填写“>”、“<”或“=”);
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大以小依次为 。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1 mol B,转移电子的物质的量为 mol。
 CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号