右图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有: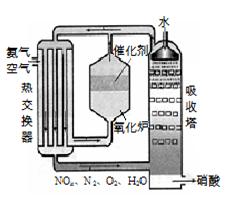
①4NH3(g)+5O2(g) 4NO(g) +6H2O(l) △H<0
4NO(g) +6H2O(l) △H<0
②2NO(g)+O2 (g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
⑴能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 ▲ 。
| A.适当升高温度 |
| B.适当增大吸收塔内的压强 |
| C.增大空气中O2的浓度 |
| D.吸收塔内填充瓷环,增大气液接触面 |
⑵在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= ▲ 。
⑶某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/c m3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
m3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 ▲ 。
②每小时从吸收塔淋下的水的质量应是多少吨?(写出计算过程)
 08 mol、mol。
08 mol、mol。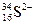 微粒中的质子数是_______,中子数是_______,核外电子数是_______。
微粒中的质子数是_______,中子数是_______,核外电子数是_______。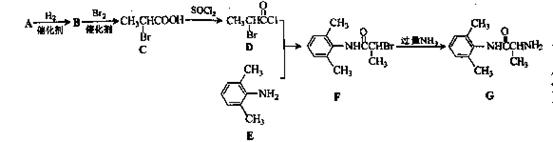 (1)已知A是
(1)已知A是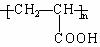 的单体,则A中含有的官能团是(写名称)。B的结构简式是。
的单体,则A中含有的官能团是(写名称)。B的结构简式是。 粤公网安备 44130202000953号
粤公网安备 44130202000953号