Ⅰ某化合物结构简式如图,请根据所示的化合物回答问题:
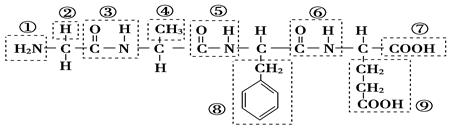
(1)该化合物中,官能团①的名称是________;官能团⑦的名称是________;该化合物是由________个氨基酸分子脱水形成的;
(2)写出该化合物水解生成的任意一种氨基酸与氢氧化钠溶液反应的化学方程式:_________________
Ⅱ食品安全关系着国民生计,影响食品安全的因素很多。
(3)聚偏二氯乙烯( )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(4)劣质植物油中的亚油酸[CH3(CH2)4—CH===CH—CH2—CH===CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是________。(填序号)
| A.分子式为C18H34O2 |
| B.一定条件下能与甘油(丙三醇)发生酯化反应 |
| C.能和NaOH溶液反应 |
| D.能使酸性KMnO4溶液褪色 |
(5)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:______________________。
(6)淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:______________。