(8)向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加的NaOH溶液的体积(mL)关系如下图所示,试回答下列问题: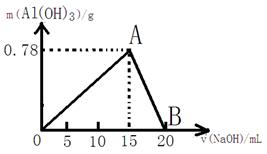
(1)上述两步反应用总的离子方程式可表示为: ;
(2)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为 。
(写出计算过程)
(8)向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加的NaOH溶液的体积(mL)关系如下图所示,试回答下列问题:
(1)上述两步反应用总的离子方程式可表示为: ;
(2)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为 。
(写出计算过程)