将2.5 g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1 mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示: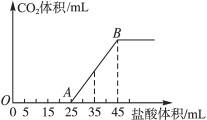
(1)写出OA段所发生反应的离子方程式:_______________________________。
(2)当加入35 mL盐酸时,产生CO2的体积为___________________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
将2.5 g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1 mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式:_______________________________。
(2)当加入35 mL盐酸时,产生CO2的体积为___________________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。