A、B、C是周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如下的关系: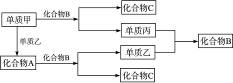
试完成下列空白:
(1)A、B、C的化学式分别为__________、__________、__________。
(2)单质甲与化合物B反应的离子方程式为:______________________________。
(3)在A、B、C三种化合物中,必定含有的元素是__________(用甲、乙、丙表示)。
A、B、C是周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如下的关系:
试完成下列空白:
(1)A、B、C的化学式分别为__________、__________、__________。
(2)单质甲与化合物B反应的离子方程式为:______________________________。
(3)在A、B、C三种化合物中,必定含有的元素是__________(用甲、乙、丙表示)。