某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种离子组成,取溶液进行如下连续实验: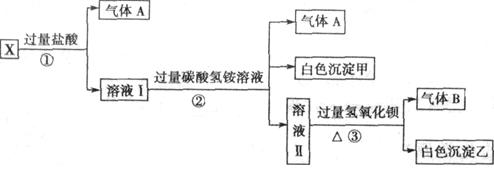
(1)白色沉淀甲是 _________。
(2)X溶液中一定存在的离子是_____________。
(3)白色沉淀乙中一定有:______,可能有_______ 证明其是否存在的方法是______________。
(4)若将过量的气体A与适量的气体B通入水中,写出反应的离子方程式_____________。
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种离子组成,取溶液进行如下连续实验:
(1)白色沉淀甲是 _________。
(2)X溶液中一定存在的离子是_____________。
(3)白色沉淀乙中一定有:______,可能有_______ 证明其是否存在的方法是______________。
(4)若将过量的气体A与适量的气体B通入水中,写出反应的离子方程式_____________。